DMD药物进展概览(仅供参考)
一、国外已经上市药物
1、 Translarna(Ataluren、Ptc124) 欧盟有条件批准 网站 www.ptcbio.com 欧洲有条件上市,适用于5岁以上尚可行走,基因确诊无义突变的患者。了解更多研究:clinicaltrials.gov ID: NCT03179631 中国目前正在开展三期临床试验。 Translarna是口服颗粒剂,每剂分别含125mg、250mg、1000mg Ataluren,推荐给药剂量每天3次,早上和中午各10mg/kg、晚上20mg/kg ,伴随液体和半固体送服。
中国武警总医院 北京,中国 100039 首席研究员:吴世文医师
联系人:张晓静+86 131 4659 1536 Xiaojing.zhang@simochina.com
福建医科大学附属第一医院 中国福州,350005 首席研究员:王宁,医学博士
联系人:黄平+86 136 6500 6621 ping.huang@simochina.com
中南大学湘雅医院 中国湖南,410008 首席研究员:费飞,医学博士
联系人:李树阳 +86 178 0731 3772 shuyang.li@simochina.com
复旦大学附属儿童医院 中国上海,200032 首席研究员:周水珍,医学博士
联系人:张顺兴电话:8617512514429 shunxin.zhang@simochina.com
深圳市儿童医院 中国深圳,518038 首席研究员:韩春喜,医学博士
联系人:李华利 +86 158 1445 0133 huali.li@simochina.com
2、 EMFLAZA®(deflazacort) 已批准 网站 www.ptcbio.com 一种糖皮质激素,用作抗炎和免疫抑制剂。于1965年获得专利,并于1985年批准用于医疗。2017年9月FDA批准Emflaza(deflazacort)片剂和口服混悬剂用于治疗5岁及以上的杜氏肌营养不良症。(DMD)。
美国Sarepta https://www.sarepta.com/
- Eteplirsen(Exondys 51) 加速批准 FDA于2016年9月决定准许该药美国上市,适合患者的基因缺失外显子51跳过。推荐剂量为每公斤30毫克,每周一次,静脉滴注35至60分钟。
- Golodirsen(Vyondys 53) 加速批准 FDA于2016年9月决定准许该药美国上市,适合患者的基因缺失外显子53跳过。VYONDYS 53的推荐剂量为30毫克/公斤,每周一次,静脉注射35至60分钟。
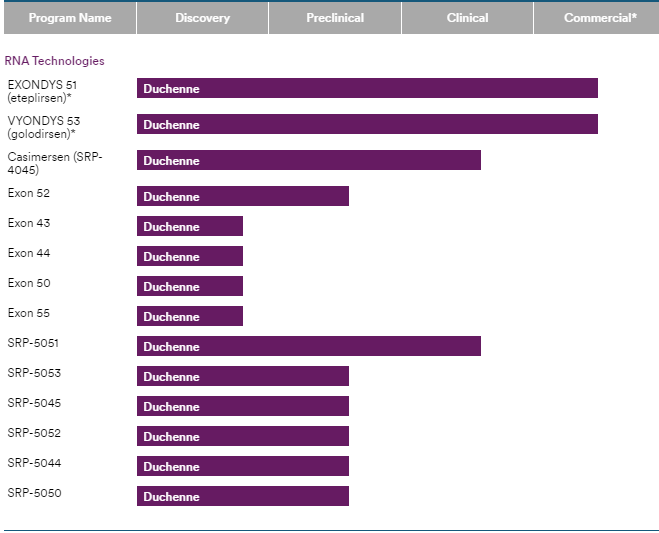
- Sarepta 外显子平台药物进展
日本新药 https://www.nippon-shinyaku.co.jp/english/
- Viltolarsen(NS-065) 日本批准 2020年3月日本批准Viltolarsen上市,适合患者的基因缺失外显子53跳过, 一周一次,静脉给药80mg/kg 1小时左右。
